García-Peláez B1*, Trias I3,4, Román R1,2, Pubill C3, Banús JM5 y Puig X1,2,3.
1BIOPAT. Biopatologia Molecular SL, Grup Assistència. 2Hospital de Barcelona-SCIAS, Grup Assistència. 3Histopat Laboratoris. 4Hospital Plató Fundació Privada. 5Institut Català d’Urologia i Nefrologia. Barcelona.
Resumen
Objetivo:
Evaluar la utilidad del estudio de alteraciones cromosómicas mediante hibridación in situ fluorescente en una serie de pacientes diagnosticados de carcinoma urotelial con un seguimiento mínimo de 24 meses, y analizar su posible efecto anticipador.
Material y métodos: La serie global incluye 338 muestras procedentes de 98 pacientes con 84 episodios de carcinoma urotelial. Para evaluar la capacidad de predicción del test, se estudió un subgrupo de 24 pacientes que presentaron como mínimo una recurrencia a lo largo del seguimiento (serie de recurrencia). Se consideraron tres categorías (episodio coherente positivo, episodio coherente negativo y episodio no coherente) en función de la relación entre los resultados de la hibridación in situ fluorescente del estudio concomitante al nuevo episodio y las muestras precedentes.
Resultados:
La hibridación in situ fluorescente presentó mayor sensibilidad independientemente del grado, valor predictivo negativo y exactitud, mientras que la especificidad y el valor predictivo positivo fueron superiores para la citología convencional. En la serie de recurrencia, 19/29 episodios resultaron coherentes, 11/19 fueron coherentes positivos, todos con carcinoma urotelial de alto grado, y 8/19 coherentes negativos, la mayoría de bajo grado.
Conclusiones:
La hibridación in situ fluorescente muestra una alta sensibilidad en un seguimiento de 24 meses y es capaz de predecir recurrencias, especialmente en casos de alto grado. Nuestros datos demuestran también la existencia de carcinomas uroteliales sin alteraciones cromosómicas detectables con la metodología actualmente disponible. Los resultados apoyan un seguimiento multidisciplinar con la utilización combinada de la hibridación in situ fluorescente, citología y cistoscopia.
PALABRAS CLAVE
Urovysion, Carcinoma urotelial, Hibridación in situ fluorescente (FISH), Citología, Recurrencia, Seguimiento
Fluorescent in situ hybridization as a predictor of relapse in urotelial carcinoma.
Abstract
Objective:
To assess the value of the study of chromosomal alterations by fluorescent in situ hybridization in a series of patients diagnosed of urothelial carcinoma and a minimum follow up of twenty four months, as well as evaluate its putative predictive potential.
Material and Methods: The overall series includes 338 samples from 98 patients with 84 episodes of urothelial carcinoma. A subgroup of 24 patients who had at least one recurrence during the follow up was used to evaluate the predictive potential of the test. Three categories were considered (positive coherent episode, negative coherent episode, and incoherent episode) depending on the relationship between the fluorescent in situ hybridization result in the concomitant study of the new episode and those of the preceding samples.
Results:
Fluorescent in situ hybridization showed higher sensitivity regardless of grade, negative predictive value and accuracy, while specificity and positive predictive value were superior with conventional cytology. In the recurrence, series 19/29 episodes were coherent, 11/19 were positive coherent with urothelial carcinoma all high grade and 8/19 negative coherent, most low grade.
Conclusions:
Fluorescent in situ hybridization test shows good sensitivity during a follow up of twenty four months and is able to predict recurrence, especially in cases of high grade. Our data demonstrate the existence of urothelial carcinomas without detectable chromosomal abnormalities by currently available methodology. The results support a multidisciplinary follow up combining fluorescent in situ hybridization, cytology and cystoscopy.
KEY WORDS
Urovysion, Urothelial carcinoma, Hybridization in situ (FISH), Cytology, Recurrence, Follow-up
INTRODUCCIÓN
La organización mundial de la salud (OMS) reconoce varios tipos histológicos de carcinomas que se originan en el urotelio vesical. El más frecuente es el carcinoma urotelial que se caracteriza por una proliferación papilar o sólida del urotelio, y en el que se reconocen dos formas de presentación. La más habitual (70%) de bajo grado (BG), es superficial, no invade el tejido subepitelial y se caracteriza por recidivar en una nueva neoplasia parecida en grado y estadio a la inicial1,2. En otros casos, el tumor es de alto grado (AG) y el riesgo de progresión e invasión es elevado con lo que aumentan las posibilidades de necesitar tratamientos agresivos. El comportamiento biológico de esta neoplasia, sobre todo en su forma de presentación superficial y de BG, implica un seguimiento estricto para detectar recidivas con cistoscopias y estudios citológicos de orina de manera periódica. Por este motivo, disponer de algún método no invasivo que detecte una recidiva con alto grado de certeza, puede ser muy útil en el manejo de la mayoría de los pacientes con carcinoma urotelial.
Actualmente, disponemos de diferentes test no invasivos basados en la detección de marcadores tumorales, sin embargo, ninguno de ellos ha podido reemplazar a la cistoscopia y la citología urinaria, técnicas de referencia para el diagnóstico y seguimiento de la enfermedad a pesar de sus limitaciones. Por ello, la mayoría de estos son utilizados como técnicas adicionales3-5. La principal desventaja de la cistoscopia reside en ser un método invasivo, mientras que la citología urinaria es altamente específica pero con baja sensibilidad, especialmente en carcinomas de BG5,7.
La hibridación in situ fluorescente (FISH) es el primer test molecular en orina que detecta la presencia de anomalías cromosómicas mediante cuatro sondas dirigidas frente a las principales alteraciones producidas en la carcinogénesis urotelial8,9.
Numerosos autores han mostrado una mayor sensibilidad de la FISH respecto a la citología urinaria, tanto en el diagnóstico como el seguimiento del carcinoma urotelial 4,5,7. Recientemente se han publicado estudios sobre el efecto “positivo anticipador” de la técnica10,11. No obstante, son pocos los estudios realizados en nuestra población y muchos menos los que demuestran el valor predictivo del test a lo largo de un periodo de seguimiento.
El principal objetivo del presente trabajo es evaluar la utilidad de la FISH comparando su sensibilidad, especificidad, exactitud, valor predictivo positivo (VPP) y valor predictivo negativo (VPN) frente a la citología convencional así como analizar su capacidad predictiva en las recurrencias.
MATERIALES Y MÉTODO
Pacientes y muestras
Las muestras estudiadas proceden de pacientes diagnosticados de carcinoma urotelial en seguimiento según el protocolo descrito en la figura 1 y basado en las guías clínicas de la EAU 12, obtenidas entre junio de 2003 y de 2010. Todos los pacientes dieron su consentimiento informado para los estudios realizados.
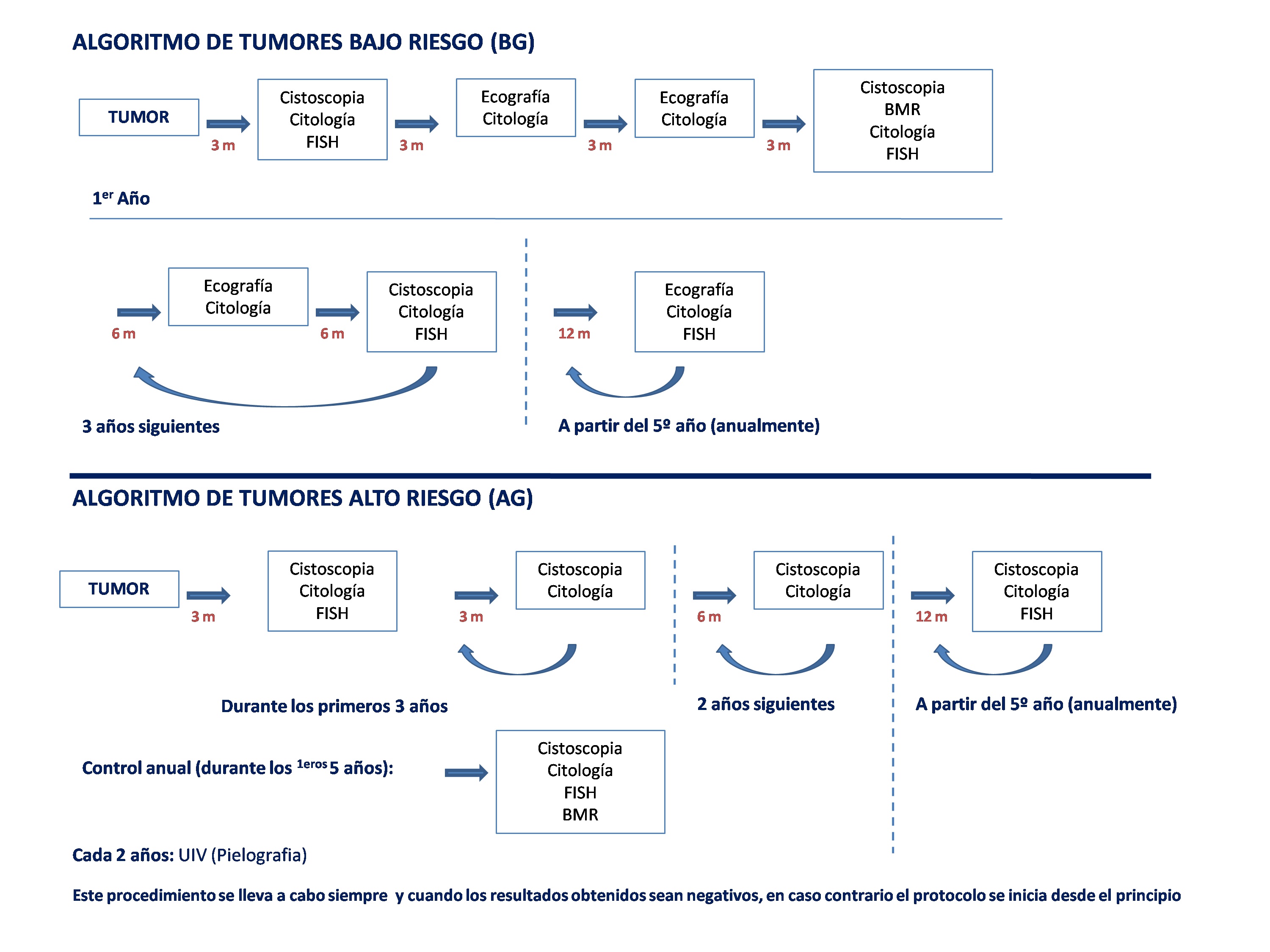 Figura 1. Algoritmo utilizado en el seguimiento de pacientes con carcinoma urotelial.
Figura 1. Algoritmo utilizado en el seguimiento de pacientes con carcinoma urotelial.
La serie está constituida por 338 muestras (161 orinas y 177 lavados vesicales) procedentes de 98 pacientes (77 hombres y 21 mujeres) con diagnostico de carcinoma urotelial y un seguimiento mínimo de 24 meses desde la obtención de la primera muestra para estudio de FISH. El tiempo promedio de seguimiento por paciente fue 52 meses (82.2-24.3). Veinticuatro pacientes presentaron como mínimo una recurrencia a lo largo del seguimiento. El estudio histológico se valoró siguiendo los criterios de la OMS (2004) para el grado y el sistema TNM (UICC 2009) para estadio. Se consideraron las siguientes categorías de FISH: Positivo, Negativo, No concluyente (NC) descritas en métodos.
Para efectuar el análisis estadístico se consideraron verdaderas positivas aquellas muestras FISH positivo o NC confirmadas por la presencia de carcinoma urotelial en concomitancia o durante los 24 meses posteriores a la obtención de la muestra. Por contra, se calificaron como verdaderas negativas, aquellas muestras FISH negativo sin biopsia ni citología positiva en concomitancia ni durante los 24 meses ulteriores. Se utilizaron los mismos criterios de verdaderas positivas y verdaderas negativas para las muestras de citología convencional.
Con el objetivo de valorar la capacidad de la FISH para prever la aparición de un carcinoma urotelial, se estudiaron 63 muestras (34 precedentes y 29 concomitantes) de los 24 pacientes que presentaron como mínimo un episodio de carcinoma urotelial a lo largo de su seguimiento. Para ello, se excluyeron las muestras obtenidas al menos 3 meses antes o después de la aparición del carcinoma urotelial, al considerarlas potencialmente no informativas puesto que podrían tratarse de resultados asociados a un carcinoma urotelial ya presente.
Se consideró episodio coherente positivo aquel que presentó una muestra concomitante FISH positivo, y al menos otra muestra anterior al carcinoma con FISH positivo, o NC. Se calificó como episodio coherente negativo, aquel que mostró una muestra concomitante FISH negativo y precedida siempre de muestras con estudios de FISH negativos. Por último, se consideró episodio no coherente aquel cuyo resultado fue discordante, siendo el carcinoma concomitante FISH positivo pero las muestras que lo preceden negativas.
Todas las muestras de orina se obtuvieron de forma espontánea o mediante lavado vesical, en el caso de exploración endoscópica. En ambos casos, las muestras se dividieron en dos alícuotas para ser analizadas por ambas técnicas.
Métodos
Hibridación in situ fluorescente (FISH)
Las células uroteliales se obtuvieron por centrifugación (1800 rpm) y utilizando Carnoy como fijador y solución de mantenimiento a -20ºC hasta el día del análisis. El pretratamiento, hibridación, lavados posthibridación y contratinción de las muestras se realizó de acuerdo con las instrucciones del kit Urovysion (Abott Molecular, Inc).
Este ensayo analiza la presencia de alteraciones cromosómicas en células uroteliales empleando cuatro sondas marcadas con fluorocromos para la detección de aneuploidías en los cromosomas (cr) 3, 7 ,17 y de la pérdida específica del locus 9p21.
El resultado se obtuvo tras evaluar la presencia de alteraciones cromosómicas en un mínimo de 20 núcleos aberrantes o 60 núcleos morfológicamente normales. Se consideró muestra positiva, la identificación de más de 5 células con polisomía (ganancia de 2 o más cromosomas) y/o más del 50% de núcleos con pérdida homocigota de 9p21. Se utilizó la categoría NC al detectarse presencia de células polisómicas y/o pérdida en homocigosis del locus 9p21, pero no suficientes para considerar la muestra como positiva.
Citología convencional
Todas las muestras se analizaron mediante citología convencional, se tiñeron con Papanicolau y posteriormente fueron evaluadas por un citotécnico (rastreo), con revisión posterior de un patólogo. Se clasificaron en las siguientes categorías diagnósticas: negativo para células malignas, atipia sospechosa de malignidad y positivo para células malignas compatible con carcinoma urotelial.
Análisis estadístico
Se utilizó el análisis de la tabla de contingencia para calcular la sensibilidad, especificidad, exactitud, VPP, VPN y el test de Fisher con un intervalo de confianza del 95% para los restantes análisis. Una p ≤0.05 se consideró estadísticamente significativa.
RESULTADOS
De 338 muestras estudiadas, un 47% mostró biopsia positiva concomitante o durante el seguimiento de 24 meses. Los resultados mostraron que la FISH presentó mayor sensibilidad, VPN y exactitud, mientras que la especificidad y el VPP fueron superiores para la citología convencional (Tabla 1).
Tabla 1. Tabla de contingencia. Serie global FISH vs. citología
|
|
FISH |
|
|
CITOLOGÍA |
|
||
|
|
BIOPSIA (+)a |
BIOPSIA (-)b |
|
|
BIOPSIA (+)1 |
BIOPSIA (-)2 |
|
|
FISH (+) |
102 |
18 |
120 |
CITOLOGÍA (+) |
58 |
4 |
62 |
|
FISH (-) |
57 |
161 |
218 |
CITOLOGÍA (-) |
101 |
175 |
276 |
|
|
159 |
179 |
338 |
159 |
179 |
338 |
|
a Resultado confirmado por biopsia positiva a lo largo del segumineto (24 meses). b Resultado no confirmado (con biopsia FISH (%) CITOLOGÍA (%) Exactitud 77.8 68.9 Sensibilidad 64.2 36.5 Especificidad 89.9 97.8 VPP 85.0 93.5 VPN 73.9 63.4 La sensibilidad de la FISH y la citología en las muestras con tumor concomitante fue de 76.2% versus 38.1% (P<0.0001), manteniéndose superior independientemente del grado. En la clasificación por estadios no se observaron diferencias significativas en tumores invasivos (Tabla 2). Tabla 2. Sensibilidad de la técnica de FISH vs. citología convencional en la detección de carcinmaurotelial para tumores concomitantes. TUMORES CONCOMITANTES (N=84) FISH CITOLOGÍA n/N % n/N % Valor de Pa n= detección positiva Grado Alto (N=53) 47/53 89 27/53 51 0.0001 Bajo (N=31) 17/31 55 5/31 16 0.0010 Estadio Ta (N=48) 34/48 71 15/48 31 0.0001 T1 (N=12) 11/12 92 6/12 50 – Tis (N=20) 16/20 80 8/20 40 0.0100 T2 (N=4) 3/4 75 3/4 75 – a Test de Fisher; n= detección positiva. Con ambas técnicas hubo un porcentaje de tumores concomitantes que no fueron detectados (falsos negativos). En el caso de la FISH no se detectaron 20 de los 84 tumores concomitantes, 70% de los cuales de BG (14 Ta, 1 T1, 4 T2, 2 Tis), mientras que la citología no detectó 52 de los 84 (33 Ta, 6 T1, 12 T2, 1 Tis), 50% de estos de BG (Figura 2). Figura 2. Distribución de casos falsos negativos en tumores concomitantes en función del gado (A) y del estadío (B). En cuanto a las muestras de pacientes con recurrencia, 19/29 episodios mostraron un resultado coherente. De estos el 58% corresponden a resultados positivos en relación al carcinoma urotelial, todos ellos de AG. El 42% restante, mostraron resultados negativos tanto en las muestras precedentes como en el carcinoma urotelial (62.5% de BG). Por el contrario, 10/29 episodios no fueron coherentes con las muestras previas a la aparición del carcinoma urotelial (40% de BG) (Tabla 3). Tabla 3. Caracterización de los episodios de carcinoma urotelial de pacientes con recurrencia. Distribución por grados y estadíos. SERIE RECURRENCIA COHERENTES NO COHERENTES TOTAL P N EPISODIOS 29 11 8 10 MUESTRAS 63 26 19 18 MUESTRAS/EPISODIOSa 2.4 2.4 1.8 GRADO AG 20 11 3 6 BG 9 5 4 ESTADIOS Ta 11 2 4 5 T1 2 1 1 0 T2 3 2 1 0 Tis 13 6 2 5 a Estadísticamente significativo p<0,05 La técnica de FISH UroVysion fue desarrollada en el año 20008,9 y aprobada por la Food and Drug Administration (FDA) en el 2005. No obstante, a pesar de que son muchos los estudios que apoyan su uso, no es un test incorporado en la rutina del urólogo. Nuestros resultados concluyen que un paciente con FISH positivo, presenta una probabilidad del 85% de tener un carcinoma urotelial o desarrollarlo a lo largo de los próximos 24 meses. Por otro lado, si el resultado de FISH es negativo podemos asegurar que no tiene un carcinoma urotelial ni lo desarrollará en los próximos 2 años con una probabilidad del 74%, y del 81% si el seguimiento se reduce a un año. En nuestro estudio, encontramos 18 muestras (5.3%) con un resultado de FISH positivo, que no presentaron biopsia positiva ni concomitante ni en los 24 meses siguientes. Denominamos a estos casos “supuestos” falsos positivos, entendiendo que con un periodo de seguimiento mayor, probablemente disminuiría este porcentaje. De hecho la existencia de alteraciones cromosómicas no implica necesariamente el desarrollo de una neoplasia en el 100% de casos 11 y, por otra parte, el intervalo temporal entre ambos eventos puede ser muy prolongado. Algunos autores han postulado que solo el 40% de los casos que presentan anomalías genéticas sin traducción clínica evolucionan a neoplasia. Para explicar el resto de los casos, se especula que las células anómalas pueden ser erradicadas por el sistema inmunitario u otros mecanismos13. Es posible, no obstante, que un bajo porcentaje de estos casos sean verdaderos falsos positivos causados por la presencia de células paraguas tetraploides, cambios celulares secundarios a infecciones virales o señales débiles del propio ensayo14. Con respecto al grupo de carcinoma urotelial concomitante, observamos mayor sensibilidad de la FISH respecto a la citología en los carcinomas superficiales (Ta) (P=0.0001) (Tabla 2). La ausencia de significación en carcinomas invasivos (T1,T2) puede ser debida al bajo número de estos casos en la serie estudiada o a la mayor sensibilidad de la citología en carcinomas de AG. Estos resultados están en concordancia con estudios previos15. En relación a los carcinomas in situ (Tis), la sensibilidad de la FISH es notablemente mejor a la de la citología (80% vs 40%) (P=0.01), resultados que refuerzan el estudio mediante FISH en este tipo de neoplasias especialmente si se tiene en cuenta la baja sensibilidad de la cistoscopia y la dificultad en la valoración de la citología en casos tratados con Bacillus Calmette Guerin (BCG) que puede llegar a ocasionar falsos positivos 16,17. En cuanto a la subclasificación por grados, de nuevo la sensibilidad de la FISH es significativamente superior a la de la citología (P≤0.001). Los casos de carcinoma urotelial no detectados por la FISH (20 episodios) corresponden en su mayoría a carcinomas de BG (70%) (Figura 2). Este hecho puede explicarse porque los carcinomas de BG suelen tener menos alteraciones genéticas y una de las más frecuentes es la pérdida del cr 9, de difícil evaluación microscópica10,16,18. Por otro lado, han sido descritas otras alteraciones no contempladas por el kit UroVysion como la pérdida del cr Y 18, ganancias en el cromosoma 20p y 5p19, u otras alteraciones en el cr1 y 820 que pueden explicar en parte este porcentaje de supuestos falsos negativos en los casos de BG. Otra posible causa es la baja descamación de células tumorales en este tipo de tumores10 ya que conservan la cohesión intercelular que suele perderse en los de AG. Para estos casos, podría ser útil la ampliación de los criterios de positividad de la técnica incluyendo la ganancia de un único cromosoma en más de 10 núcleos, que utilizan algunos autores11. En cuanto a los casos con recurrencias, encontramos una mayoría de episodios coherentes (Tabla 3), de los cuales 11 presentaron muestras precedentes positivas en concordancia con el resultado de FISH concomitante al carcinoma urotelial. Estos resultados refuerzan el efecto anticipatorio de la técnica ya descrita por otros autores especialmente en los casos de AG10. Por otro lado, debemos destacar los 8 episodios con resultados coherentes en negativo, 62.5% de BG, que sugieren la presencia de ciertos tipos de carcinoma urotelial sin alteraciones cromosómicas, o al menos no detectables por esta técnica. Con referencia a los 10 episodios no coherentes (40% de BG), mencionar que presentan menos estudios de FISH por episodio que los casos coherentes (P<0.05), y registran mayor número de muestras realizadas antes de los 12 meses de la aparición del carcinoma, lo cual podría justificar la ausencia de alteraciones genéticas. Con estos resultados podemos afirmar que la técnica de FISH aporta alta sensibilidad en un seguimiento de 24 meses y es capaz de predecir la aparición de recurrencias, especialmente en casos de AG. Nuestros datos parecen indicar que existen carcinomas uroteliales no detectables mediante esta técnica, sobre todo de BG, por lo que son necesarios más estudios para confirmar la existencia de otras alteraciones genéticas e incorporarlas al test. Nuestras conclusiones apoyan el seguimiento multidisciplinar del carcinoma urotelial con la utilización combinada de FISH, citología y cistoscopia. Actas Urol Esp. 2013; 37: 395-400
DISCUSIÓN
BIBLIOGRAFíA
