INTRODUCCIÓN
El gen HER2, ubicado en el brazo largo del cromosoma 17, codifica un receptor de membrana con actividad tirosina-cinasa involucrado en regulación de la proliferación celular, la motilidad y la apoptosis.
Entre el 15 y el 20% de los carcinomas de mama presentan amplificación de HER2 y la consecuente sobreexpresión de la proteína. Esta alteración se asocia a peor pronóstico (mayor tasa de recurrencia y mortalidad) y múltiples estudios han demostrado su valor predictivo para sensibilidad o resistencia a distintos regímenes de terapia sistémica, tanto de tipo endocrino (tamoxifen) como quimioterápico (antraciclinas), justificando su inclusión en los paneles de decisión clínica, junto a los factores pronósticos y predictivos clásicos del carcinoma de mama.
El interés primordial de este gen reside en su papel como diana terapéutica del trastuzumab (Herceptin®), anticuerpo monoclonal humanizado capaz de bloquear la acción del receptor HER2. Esta nueva terapia fue aprobada por la FDA en 1998, limitándola inicialmente a pacientes con enfermedad diseminada. Más recientemente se ha demostrado que el empleo de trastuzumab en estadíos iniciales de la enfermedad, como agente único o en regímenes combinados, reduce significativamente tanto el riesgo de recurrencia como la mortalidad.
La aplicación terapéutica en fases iniciales y el hecho de que la respuesta depende de la alteración del gen, han convertido en esencial el estudio de HER2. Actualmente se considera obligado efectuarlo en todos los casos diagnosticados de carcinoma de mama invasivo y además es crítica su fiabilidad, tanto por el alto coste del tratamiento y su riesgo no despreciable de toxicidad cardíaca (5-15%) como por el perjuicio que supone negar esta opción terapéutica a una paciente susceptible de responder.
Otros fármacos dirigidos a HER2 (por ejemplo, el inhibidor de cinasa lapatinib, el anticuerpo pertuzumab, y el conjugado anticuerpo-fármaco adotrastuzumab emtansina
MÉTODOS DE ESTUDIO E INDICACIÓN TERAPÉUTICA
La inmunohistoquímica (IHQ) y la hibridación “in situ” fluorescente (FISH) son los métodos más utilizados para el estudio de HER2. Ambos permiten la interpretación de resultados sobre el contexto microanatómico. Con la IHQ se evalúa el grado de expresión de la proteína en la membrana celular y con FISH se evalúa el número de copias del gen en el núcleo celular para detectar su amplificación. Mientras que la IHQ está incorporada en muchos laboratorios de Patología, la técnica de FISH es menos asequible, requiere equipamiento de mayor coste y es difícil de implementar y acumular experiencia en laboratorios con bajo volumen de actividad.
La literatura de los últimos años ha proporcionado múltiples estudios comparativos entre ambos métodos con resultados variables pero, en general, el análisis comparativo de sus conclusiones es complejo por la ausencia de estandarización entre distintos ensayos, tanto en aspectos técnicos como de interpretación y confirmación de resultados. Algunos autores han defendido la mayor fiabilidad de la técnica de FISH, pero en los ensayos clínicos se ha utilizado preferentemente IHQ y, en algunos de ellos, se han detectado importantes discordancias entre los resultados del primer laboratorio que efectuaba el test y los de un laboratorio de referencia de mayor volumen que lo repetía con posterioridad, antes de indicar el tratamiento. En un 20% de casos el primer resultado se consideró incorrecto. Esta variabilidad de resultados se atribuye a factores preanalíticos, como la fijación y el procesado tisular, analíticos, como los reactivos o los procedimientos del laboratorio, y postanalíticos, como los criterios de interpretación de resultados.
Con la totalidad de los datos actualmente disponibles en la literatura, no puede demostrarse superioridad de ninguno de los dos métodos respecto al otro para predecir respuesta a la terapia anti-HER2, pero sí se ha evidenciado que es esencial emplear metodología adecuadamente validada independientemente del método elegido.
Los algoritmos de decisión terapéutica consensuados y utilizados hasta la actualidad, asumiendo un alto nivel de concordancia entre IHQ y FISH no claramente justificado por la literatura disponible, recomiendan la utilización de IHQ como test primario, indicando FISH sólo en los casos de positividades intermedias, no concluyentes (2+). Los casos de alta positividad (3+) se consideran candidatos a trastuzumab y los de positividad baja (1+) o nula se informan como negativos y no se consideran susceptibles de respuesta.
Este protocolo de estudio está supeditado a la fiabilidad del laboratorio que efectúa el test y vinculado a un volumen mínimo de casos anuales que acrediten su experiencia. También se ha enfatizado la necesidad de documentar en el laboratorio la concordancia entre FISH e IHQ (90% para IHQ 0 y 3+ y 95% para IHQ 1+) antes de limitar la aplicación de FISH a los casos de IHQ 2+. Sin embargo, ninguna de estas condiciones se cumple de manera sistemática en la práctica asistencial y muy probablemente se están generando indicaciones y exclusiones inadecuadas del tratamiento en un porcentaje sustancial de pacientes.
Estos algoritmos son previos a la publicación de los resultados de trastuzumab en tratamiento adyuvante y sus exigencias de concordancia se orientaban esencialmente a una situación de enfermedad avanzada, con carácter más paliativo, y no a la mejora de la sobrevida demostrada en fases iniciales de la enfermedad. En este nuevo contexto, el protocolo óptimo debe identificar la totalidad de las pacientes con alteraciones de HER2 que pueden beneficiarse de la nueva terapia (sensibilidad 100%), y también las que no las presentan y deben dirigirse a otros regímenes terapéuticos, evitando riesgos y costes innecesarios (especificidad 100%).
La distancia entre estos objetivos y la realidad actual motivó una iniciativa conjunta del “College of American Pathologists” (CAP) y la “American Society of Clinical Oncology” (ASCO) que ha proporcionado una guía de recomendaciones para el test de HER2 recientemente actualizada (Recommendations for HER2 Testing in Breast Cancer: ASCO&CAP Guideline Update. J Clin Oncol. 2013;31(31):3997-4013.)
SÍNTESIS DE RECOMENDACIONES (ASCO & CAP 2013)
1. Condiciones y evaluación del estudio de HER2
Debe realizarse el estudio de HER2 en todos los casos diagnosticados de carcinoma de mama invasivo y, en caso de que aparezcan, en sus metástasis. Esto debe ser especialmente considerado en pacientes con tumor primario HER2 negativo y que presenten recurrencia de la enfermedad con un comportamiento clínico sugestivo de HER2 positivo o triple negativo.
Para clasificar el estado de HER2 como positivo o negativo el laboratorio debe demostrar previamente la concordancia de sus resultados con un test de FISH validado, confirmando que las discordancias no superan el 5% en ninguna de las dos categorías. Si el laboratorio no cumple estas condiciones no realizar el test.
Las condiciones de manipulación y tratamiento previo de la muestra deben estar estandarizadas y deben especificarse en cada caso. El fijador idóneo es el formol neutro tamponado al 10% y el tiempo de fijación óptimo es de 6 a 72 horas, variando según el volumen de la muestra.
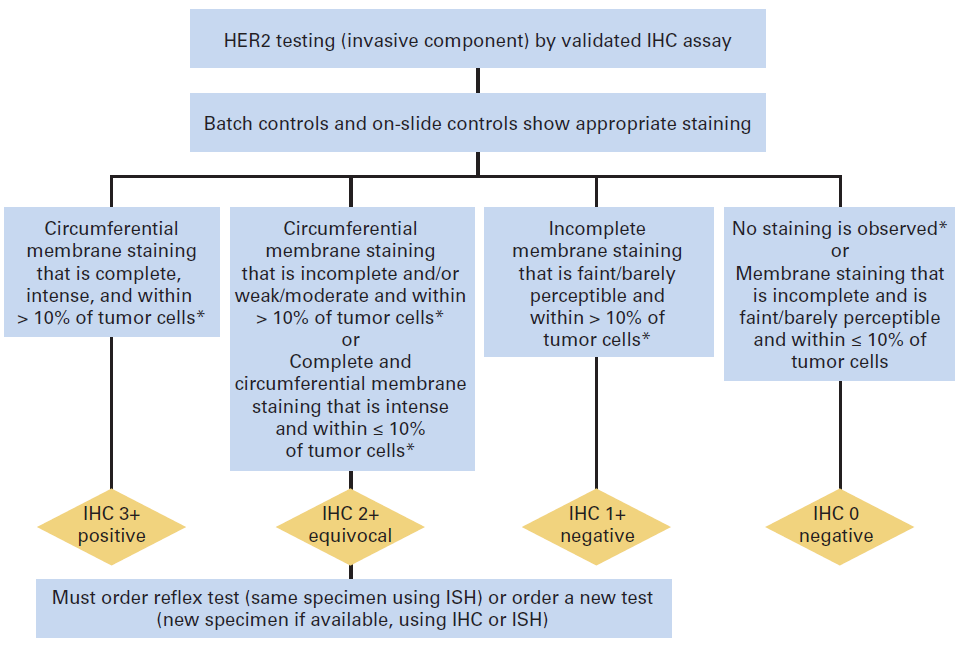
Los resultados deben evaluarse sólo en el componente invasivo del tumor y los criterios de interpretación e informe de resultados deben estar estandarizados. Se establecen tres categorías (negativo, positivo, equívoco) y los criterios que determinan la exclusión del test de muestras en estado subóptimo. Como controles pueden emplearse líneas celulares o bloques de tumores con representación de las tres categorías de resultados. Si los controles no presentan los resultados esperados debe repetirse la técnica.
La importancia clínica de la polisomía (duplicación de un cromosoma entero una o más veces) y de la monosomía (pérdida completa de un cromosoma) en ausencia de sobreexpresión de HER2 por IHQ es desconocida. Existe un gran número de publicaciones al respecto sin que se haya podido demostrar la existencia de relación entre la aneusomía y la respuesta a terapia dirigida a HER2. La polisomía parece ser más común que la monosomía, pero estudios recientes han demostrado que la verdadera polisomía del cromosoma 17 es realmente rara (8%). Sin embargo, la pérdida o ganancia de la región pericentromérica del cromosoma 17 es más comúnmente observada y puede dar lugar a alteraciones en la proporción HER2/CEP17 y consecuentemente falsos positivos o falsos negativos del cociente HER2/CEP17 en FISH, como ocurre también con la monosomía. Esta actualización incorpora el número de copias de HER2 para evitar este tipo de resultados falsos.
HER2 positivo:
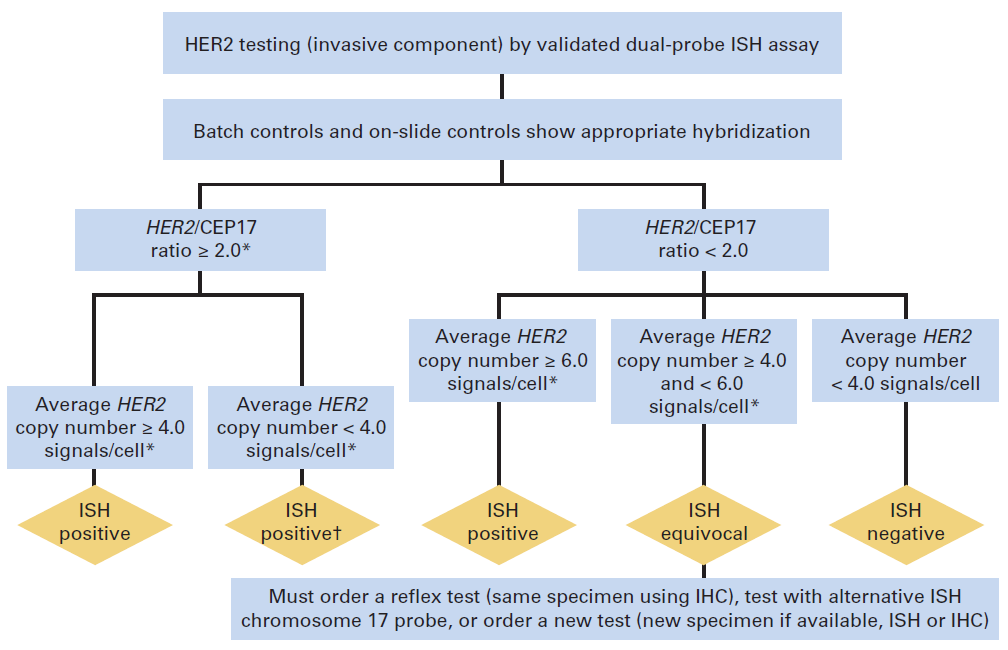
En IHQ consiste en positividad de membrana intensa y uniforme (3+) en más del 10% de células neoplásicas invasivas. En FISH sin sonda centromérica, se define por la identificación de 6 o más copias del gen por núcleo, y en FISH con sonda centromérica, por un cociente HER2/CEP17 igual o superior a 2.0, siendo CEP17 la señal centromérica del cromosoma 17, o bien, por un cociente HER2/CEP17 inferior a 2.0 con un 6 o más copias del gen por núcleo
HER2 negativo:
En IHQ consiste en la ausencia de tinción o expresión de membrana débil, incompleta, en menos del 10% de células tumorales (0) o en positividad 1+, definida como expresión de membrana débil, incompleta, en una proporción de células igual o superior al 10%. En FISH se considera negativo el número de copias por núcleo inferior a 4 o el cociente HER2/CEP17 inferior a 2.0 con un número de copias por núcleo inferior a 4. El porcentaje de falsos negativos debe tender al 0% y nunca superar el 5%.
HER2 equívoco:
Las confusiones generadas en torno a la metodología del test para HER2 proceden de la necesidad de definir una variable categórica, la indicación o no del tratamiento con trastuzumab, a partir de una variable continua, el grado de expresión o amplificación identificado en el test. Este hecho genera, en la práctica, situaciones intermedias de difícil resolución.
El rango equívoco para la IHQ son los casos etiquetados como expresión 2+, que suponen aproximadamente el 15%, y se definen como la positividad de membrana no uniforme o de intensidad débil, pero completa o circunferencial en el 10% o más de células. Otro resultado, de escasa incidencia, que se considera también equívoco, es la expresión de membrana intensa y completa pero no superior al 10% de células. En FISH se considera equívoco un cociente HER2/CEP17 2.0 con un número de copias por núcleo entre 4 y 6, este último no incluido.
Los resultados equívocos de IHQ requieren confirmación por FISH. Si el test primario utilizado es el FISH, los resultados equívocos requieren contaje adicional o repetir el test completo. Si persiste el resultado equívoco debe efectuarse IHQ. Ver figuras 1 y 2.
En caso de observar discordancia entre el resultado de HER2 y la histología del caso, el patólogo debe consultar con el oncólogo, y documentar el resultado en el informe de anatomía patológica.
Exclusiones:
Tanto en IHQ como en FISH, se excluyen del test las muestras con deficiencias de fijación, artefactos que impiden la evaluación correcta o representación insuficiente de carcinoma invasivo.
2. Validación del test
El test debe ser validado por el laboratorio antes de su aplicación asistencial, demostrando un 95% de concordancia en la comparación con un test de referencia validado anteriormente y realizado en paralelo. Los laboratorios que no dispongan de ningún test previamente validado deben efectuarlo en paralelo con otro laboratorio que pueda ofrecerlo. El número de casos a estudiar en paralelo puede oscilar entre 25 y 100 dependiendo de la variabilidad de resultados.
En general existe acuerdo en recomendar que no se efectúe el estudio en laboratorios con escaso volumen anual. Los procedimientos de estudio deben estar estandarizados y cualquier desviación del método debe justificarse con un proceso de revalidación.
En los laboratorios con múltiples patólogos es recomendable que un número reducido de ellos concentre el estudio de HER2 para acumular mayor experiencia y, entre ellos, debe mantenerse una concordancia en la interpretación de resultados del 95%. El análisis de imagen puede ser útil en la interpretación pero sus resultados siempre debe confirmarlos un patólogo y los equipos deben estar correctamente calibrados y con programas de mantenimiento y control de calidad interno.
3. Programa de acreditación de laboratorios
Los laboratorios que efectúan el estudio de HER2 deben participar en un programa de capacitación específico para cada método empleado. Este programa distribuirá muestras al menos tres veces al año, incluyendo un número suficiente de casos para asegurar la valoración adecuada de la capacidad del laboratorio. Las muestras pueden presentarse en secciones convencionales o en “microarrays” tisulares.
4. Algoritmos de decisión terapéutica
Están supeditados al cumplimiento de las condiciones expuestas anteriormente y contemplan dos opciones según se emplee IHQ o FISH como técnica primaria. Ver figuras 1 y 2.
Figura 1. Algoritmo para IHQ como técnica primaria.
• De “Wolff AC, Hammond EH, Hicks DG et al: Recommendations for Human Epidermal Growth Factor Receptor 2 Testing in Breast Cancer: American Society of Clinical Oncology/College of American Pathologists Clinical Practice Guideline Update. J Clin Oncol. 2013;31(31):3997-4013.”
Figura 2. Algoritmo para FISH como técnica primaria, utilizando doble sonda (HER2/CEP17).
• De “Wolff AC, Hammond EH, Hicks DG et al: Recommendations for Human Epidermal Growth Factor Receptor 2 Testing in Breast Cancer: American Society of Clinical Oncology/College of American Pathologists Clinical Practice Guideline Update. J Clin Oncol. 2013;31(31):3997-4013.”
Bibliografía:
- Slamon DJ, Clark GM, Wong SG, et al: Human breast cancer: Correlation of relapse and survival with amplification of the HER-2/neu oncogene. Science 235:177–182, 1987
- Slamon DJ, Leyland-Jones B, Shak S, et al: Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2. N Engl J Med 344:783–792, 2001
- Roche PC, Suman VJ, Jenkins RB, et al: Concordance between local and central laboratory HER2 testing in the breast intergroup trial N9831. J Natl Cancer Inst 94:855–857, 2002
- Hanna W, O’Malley F: Updated recommendations from the HER2/neu consensus meeting. Current Oncology 9:S18–S19, 2002 (suppl 1)
- Bilous M, Dowsett M, Hanna W, et al: Current perspectives on HER2 testing: A review of national testing guidelines. Mod Pathol 16:173–182, 2003
- Yaziji H, Goldstein LC, Barry TS, et al: HER-2 testing in breast cancer using parallel tissue-based methods. JAMA 291:1972–1977, 2004
- Ellis IO, Bartlett J, Dowsett M, et al: Best practice No 176: Updated recommendations for HER2 testing in the UK. J Clin Pathol 57:233–237, 2004
- Owens MA, Horten BC, Da Silva MM: HER2 amplification ratios by fluorescence in situ hybridization and correlation with immunohistochemistry in a cohort of 6556 breast cancer tissues. Clin Breast Cancer 5:63–69, 2004
- Konecny GE, Thomssen C, Luck HJ, et al: Her-2/neu gene amplification and response to paclitaxel in patients with metastatic breast cancer. J Natl Cancer Inst 96:1141–1151, 2004
- Press MF, Sauter G, Bernstein L, et al: Diagnostic evaluation of HER-2 as a molecular target: An assessment of accuracy and reproducibility of laboratory testing in large, prospective, randomized clinical trials. Clin Cancer Res 11:6598–6607, 2005
- Hicks DG, Tubbs RR: Assessment of the HER2 status in breast cancer by fluorescence in situ hybridization: A technical review with interpretive guidelines. Hum Pathol 36:250–261, 2005
- Tan-Chiu E, Yothers G, Romond E, et al: Assessment of cardiac dysfunction in a randomized trial comparing doxorubicin and cyclophosphamide followed by paclitaxel, with or without trastuzumab as adjuvant therapy in node-positive, human epidermal growth factor receptor 2-overexpressing breast cancer: NSABP B-31. J Clin Oncol 23:7811–7819, 2005
- Piccart-Gebhart MJ, Procter M, Leyland-Jones B, et al: Trastuzumab after adjuvant chemotherapy in HER2-positive breast cancer. N Engl J Med 353:1659–1672, 2005
- Romond EH, Perez EA, Bryant J, et al: Trastuzumab plus adjuvant chemotherapy for operable HER2-positive breast cancer. N Engl J Med 353:1673–1684, 2005
- Verdú M, Colomer A, Román R, et al: Protocolo de estudio molecular del oncogén HER2/neu en el carcinoma de mama. Clin Transl Oncol 7: 504-511, 2005
- Fitzgibbons PL, Murphy DA, Dorfman DM, et al: Interlaboratory comparison of immunohistochemical testing for HER2: Results of the 2004 and 2005 College of American Pathologists HER2 immunohistochemistry tissue microarray survey. Arch Pathol Lab Med 130:1440–1445, 2006
- Reddy JC, Reimann JD, Anderson SM, et al: Concordance between central and local laboratory HER2 testing from a community-based clinical study. Clin Breast Cancer 7:153–157, 2006
- Villman K, Sjostrom J, Heikkila R, et al: TOP2A and HER2 gene amplification as predictors of response to anthracycline treatment in breast cancer. Acta Oncol 45:590–596, 2006
- The Herceptin Adjuvant (HERA) Trial Study Team: Trastuzumab following adjuvant chemotherapy in HER2-positive early stage breast cancer (HERA trial): Disease-free and overall survival after 2 year follow-up. J Clin Oncol 24, 2006 presented as a late breaking abstract at the 42nd Annual Meeting of the American Society of Clinical Oncology, Atlanta, GA, June 2–6, 2006
- Perez EA, Suman VJ, Davidson NE, et al: HER2 testing by local, central, and reference laboratories in specimens from the North Central Cancer Treatment Group N9831 Intergroup adjuvant trial. J Clin Oncol 24:3032–3038, 2006
- Persons DL, Tubbs RR, Cooley LD, et al: HER-2 fluorescence in situ hybridization: Results from the survey program of the College of American Pathologists. Arch Pathol Lab Med 130:325–331, 2006
- Wolff AC, Hammond EH, Schwartz JN, et al: American Society of Clinical Oncology/College of American Pathologists Guideline Recommendations for Human Epidermal Growth Factor Receptor 2 Testing in Breast Cancer. Arch Pathol Lab Med 131: 2007; 131: 18-43, 2007
- Penault-Llorca F, Coudry RA, Hanna WM et al:Experts’ opinion: Recommendations for retesting breast cancer metastases for HER2 and hormone receptor status. The Breast 2013;22:200-2
- Wolff AC, Hammond EH, Hicks DG et al: Recommendations for Human Epidermal Growth Factor Receptor 2 Testing in Breast Cancer: American Society of Clinical Oncology/College of American Pathologists Clinical Practice Guideline Update. J Clin Oncol. 2013;31(31):3997-4013
- Hanna WM, Rüschoff J, Bilous M et al: HER2 in situ hybridization in breast cancer: clinical implications of polysomy 17 and genetic heterogeneity. Modern Pathology 2014; 27, 4–18
02 / 2014 / Montse Verdú